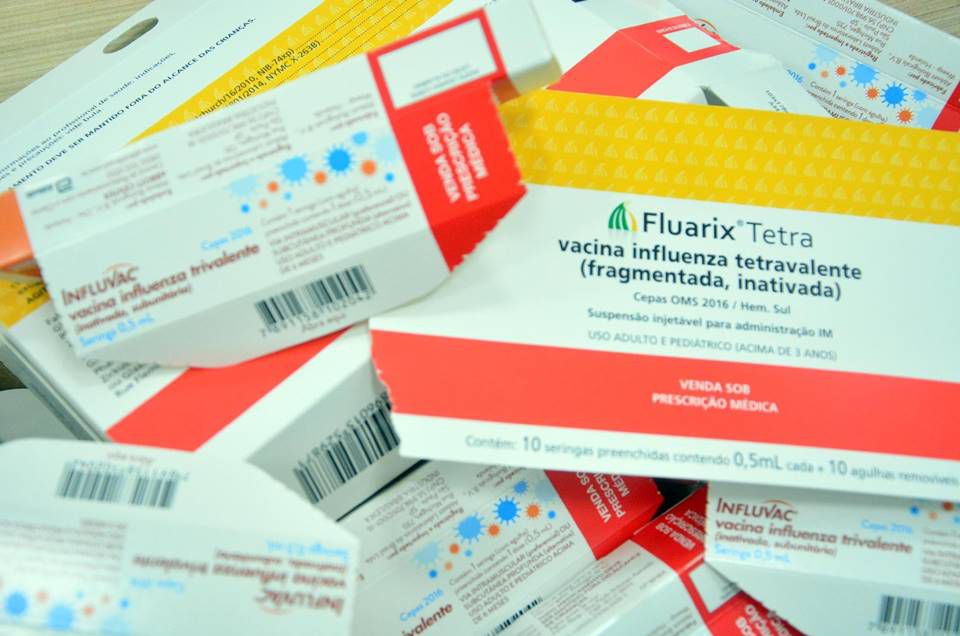
Anvisa alerta sobre falsificação de vacina contra gripe
| 8671 viewsA Anvisa alerta que foram identificados três casos de falsificação da vacina Fluarix Tetra, da empresa GlaxoSmithKline Brasil (GSK), utilizada para prevenir a influenza ou gripe. A vacina falsificada é vendida na apresentação frasco-ampola multidose, ou seja, um frasco que permite que várias doses sejam retiradas e aplicadas em diversas pessoas, conforme a Figura 3.