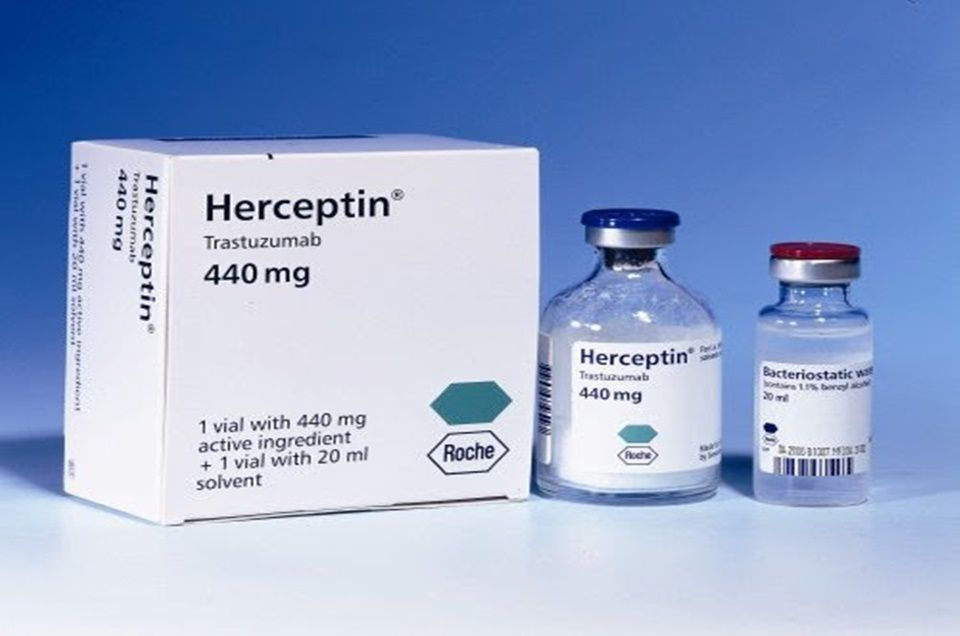
A Agência Nacional de Vigilância Sanitária (Anvisa) determinou o recolhimento (voluntário) de quatro lotes (N3930B04, N3931B10, N3932B03, N3936B04) do Herceptin, indicado para o tratamento de pacientes com câncer de mama. Nessa situação, a empresa responsável pelo medicamento é a Roche Químicos e Farmacêuticos.
A medida foi estabelecida por meio da Resolução (RE) 2.286, de 2 de junho de 2020, no Diário Oficial da União (D.O.U.) e foi motivada em função da presença de partículas provenientes de delaminação do frasco diluente.
Em nota enviada à redação do ICTQ, a Roche confirmou que iniciou a ação de recolhimento de “quatro lotes do medicamento oncológico Herceptin (trastuzumabe) 440 mg”. De acordo com a empresa, “durante um processo global de controle de amostras foram detectadas partículas suspensas - vestígios de componentes dos frascos no diluente que acompanha o produto, levando a empresa a essa decisão (medida)”.
Receba nossas notícias por e-mail: Cadastre aqui seu endereço eletrônico para receber nossas matérias diariamente
A empresa esclarece que os frascos do medicamento Herceptin 440mg (contendo pó liofilizado) não apresentam qualquer desvio de qualidade e que o evento relatado acima refere-se, exclusivamente, ao frasco do diluente que integra a embalagem da apresentação de 440mg. “A segurança do paciente é sempre a prioridade para a Roche e, por isso, apesar da baixa probabilidade de lesão significativa, foi decidido efetuar o recolhimento voluntário”, ressalta.
A companhia destaca ainda: “Lamentamos profundamente qualquer interrupção que esse recolhimento do produto possa causar aos pacientes brasileiros. A Roche está empenhada na busca de soluções para contornar esse problema a fim de não impactar o tratamento dos pacientes”, pontua.
Por fim, enfatiza: “Atualmente estamos trabalhando em estreita colaboração com as autoridades de saúde e nossos parceiros do sistema de saúde para garantir que o impacto do recolhimento seja minimizado. A empresa reforça a busca constante por fornecer produtos que atendam aos mais altos padrões de qualidade, [por isso] informou à Anvisa, aos órgãos de defesa do consumidor e às autoridades de saúde, seguindo as legislações aplicáveis. O evento em questão não abrange a apresentação de Herceptin150 mg, que não é acompanhada de diluente”, encerra. A RE 2.286/20 pode ser conferida no Diário Oficial (veja aqui).
Cautela sobre recolhimentos
É importante ressaltar que no caso desse recolhimento do Herceptin, citado na RE 2.286/20, a medida foi identificada como voluntária, ou seja, solicitada pela própria empresa. Nessas situações, muitas vezes, a ação pode funcionar apenas como uma ação de controle interno.
Vale lembrar ainda que a medida é válida apenas para o lote citado pela Agência reguladora. Em caso de dúvidas, ou da identificação de alguma unidade entre os produtos destacados na resolução, o mais adequado é entrar em contato com a empresa farmacêutica responsável pelo medicamento e obter mais informações sobre o procedimento.
Participe também: Grupo de WhatsApp e telegram para receber notícias farmacêuticas diariamente
Obrigado por apoiar o jornalismo profissional
A missão da Agência de notícias do ICTQ é levar informação confiável e relevante para ajudar os leitores a compreender melhor o universo farmacêutico. O leitor tem acesso ilimitado às reportagens, artigos, fotos, vídeos e áudios publicados e produzidos, de forma independente, pela redação da Instituição. Sua reprodução é permitida, desde que citada a fonte. O ICTQ é o principal responsável pela especialização farmacêutica no Brasil. Muito obrigado por escolher a Instituição para se informar.