Desde o final de fevereiro de 2020, a pandemia desencadeada pelo vírus da síndrome respiratória aguda grave 2 (SARS-CoV-2) tem influenciado a história de todo o mundo (literalmente, sem nenhum exagero...). Talvez tenha passado na cabeça de muitos esta pergunta: Como pode um vírus medindo cerca de 50 a 200 nm fazer tanto “estrago” assim? Porque além da sua alta transmissibilidade (1 infectado: 3 não-expostos), exige-se altas demandas de internação dos infectados principalmente em pacientes idosos e/ou com comorbidades, predispondo a um potencial colapso dos sistemas de saúde em pouco tempo, especialmente os setores de terapia intensiva. Somado a tudo isso, como ainda pouco se sabe sobre eficazes estratégias farmacoterapêuticas contra o COVID-19* e suas complicações desencadeadas pela “tempestade imunológica”, essa doença tem sido nas últimas semanas um alvo comum de investigação mundial para mitigar sua progressão.
Apesar da história da infectologia registrar diversas outras pandemias [Gripe Espanhola (H1N1)-1918; Gripe asiática (H2N2)-1957; Gripe de Hong Kong(H3N2) – 1968; Gripe Russa (H1N1)-1977 e Gripe Suína(H1N1)-2009]1 , esta nova pandemia por COVID-19 apresenta um caráter peculiar, sem precedentes: a robusta capilaridade das mídias sociais entre a população mundial associada a uma gama de potenciais estratégias farmacoterapêuticas. Apesar da indiscutível vantagem dessa inovadora e revolucionária forma de comunicação, muitas informações de caráter médico/científico frequentemente diluídas em informações duvidosas (ou até mesmo mal interpretadas) são compartilhadas tanto para os profissionais de saúde como para o público leigo, refletindo diretamente em atitudes da sociedade que contribuem, paradoxalmente, para sua própria vulnerabilidade.
Como exemplo, o episódio da busca desenfreada pela cloroquina/hidroxicloroquina nas farmácias e drogarias brasileiras na segunda quinzena de março de 2020 foi apenas um primeiro reflexo desse novo tipo de comportamento que merece e sempre merecerá uma pronta resposta das agências reguladoras e dos Conselhos Federais de Medicina e Farmácia (conforme ocorrido de forma exemplar) visando a plena proteção da população brasileira. Outro caso mais recente foi a rápida disseminação de um artigo científico publicado em 03/04/2020 que apresentava o “sucesso anti-COVID-19” através do clássico anti-parasitário (ivermectina) já aprovado pelo FDA para uso humano desde 1987 2. Só se esqueceram de um detalhe: há uma importante expressão no final do próprio título do artigo publicado na Antiviral Research: “in vitro”...
Portanto, muita calma nesta hora! Nesta última semana, fiz questão de investigar todos os estudos clínicos já registrados contra o COVID-19 que inclusive muitos deles ainda nem recrutaram seus pacientes...Dentre os 366 já cadastrados (basta conferir no site www.clinicaltrials.gov), estratégias de todo o tipo podem ser encontradas: mel egípcio, sildenafil, levamisol, proteína recombinante ECA-2, terapia com células-tronco e até nebulização com líquido aminiótico para diminuir a resposta inflamatória pelo SARS-CoV-2.
Para toda boa intenção na área farmacológica, surge um alerta! Na minha opinião, costumo dizer que qualquer farmacoterapia pode ser como uma caixa de morangos...você pode até desejar os “vermelhinhos que brilham em cima”, mas frequentemente podem vir outros ‘podres e verdes’ escondidos logo ali, abaixo...Portanto, não se pode dissociar os riscos iminentes das farmacoterapias investigadas contra o COVID-19. Além dos conhecidos efeitos colaterais, elas podem estar envolvidas em uma gama de interações medicamentosas (fármaco-fármaco, fármaco-alimento; fármaco-doença; fármaco-status fisiológico) que merecem destaque (e ao mesmo tempo uma reflexão) principalmente para os pacientes que se encontram na fase desses testes clínicos (trials) e certamente tem sido alvos de uma polifarmácia.
Diante da precocidade histórica dessa doença, farei ao máximo para realizar as recomendações baseadas em potenciais riscos e evidências atuais de forma responsável e mais transparente possível. É bom deixar claro que como a maioria das estratégias farmacoterapêuticas para o COVID-19 ainda estão em estudo, recorremos às terapias em potencial classificadas até o início de abril de 2020. Alguns fármacos vêm ganhando destaque na comunidade científica, seja na tentativa de inibir a replicação viral inibindo a RNA polimerase (remdesivir), na contenção da replicação viral pela inibição de proteases (lopinavir/ritonavir) ou até pelo possível bloqueio da endocitose viral, resultando em falha no transporte adicional de virions por meio do aumento do pH lisossomal (cloroquina/hidroxicloroquina). Recentemente, um estudo realizado na França demonstrou efeitos benéficos na redução da carga de COVID-19 em 5 dias em 6 (seis) pacientes tratados com uma associação de hidroxicloroquina com o macrolídeo azitromicina (utilizado no estudo para evitar a coinfecção bacteriana)3. Entretanto, enfatizo: para todas estas estratégias, ainda faltam robustas bases científicas. Por isso acalme-se: a farmacologia é assim mesmo, cheia de fronteiras ilimitadas e inconstantes. O que devemos fazer? Estudar, estudar, estudar....
A fim de facilitar a visualização das principais interações medicamentosas desses possíveis “candidatos anti-COVID-19”, as mesmas serão apresentadas nas tabelas a seguir, seguidas de rápidas explicações com significados clínicos. Portanto, “divirta-se”!
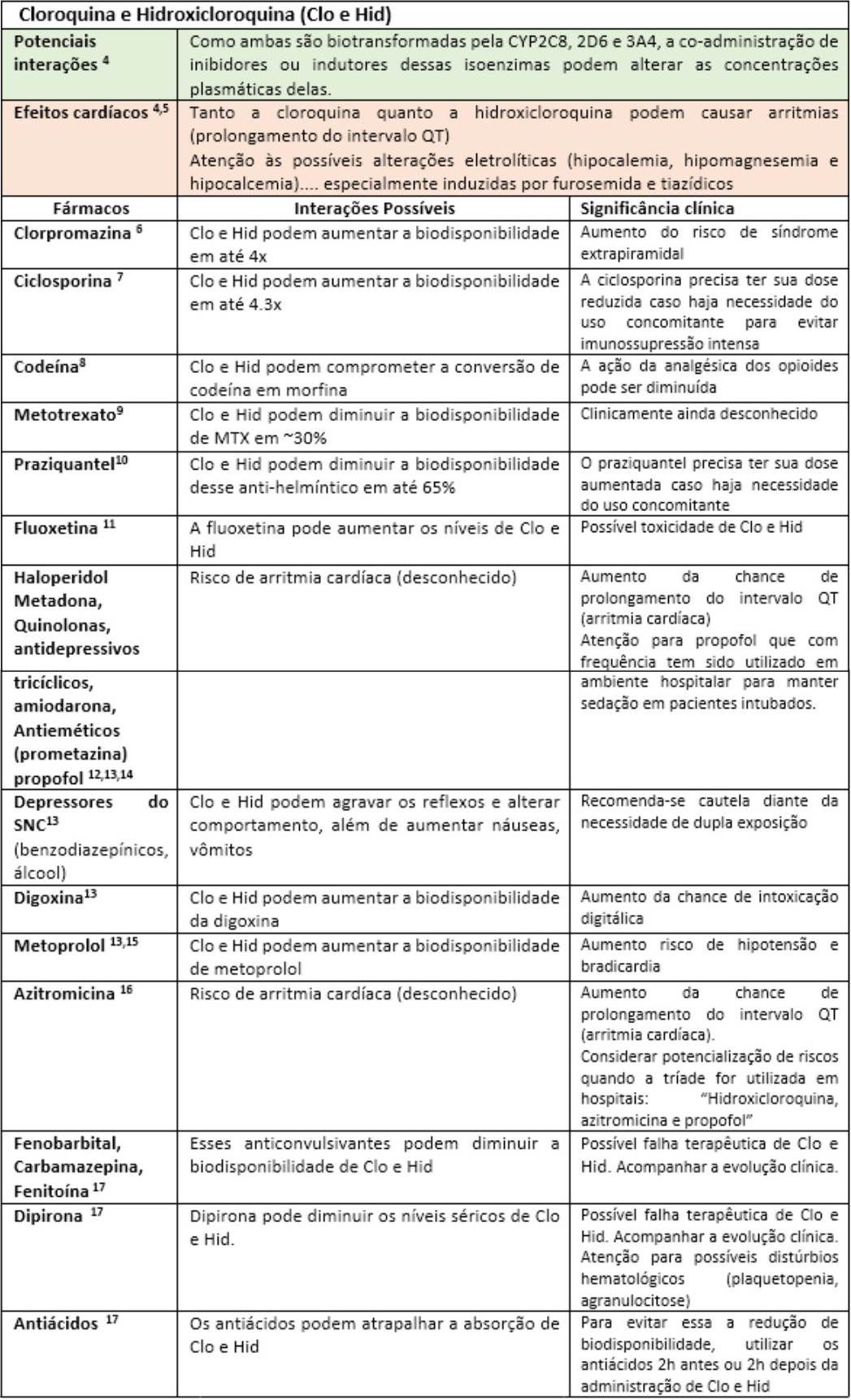
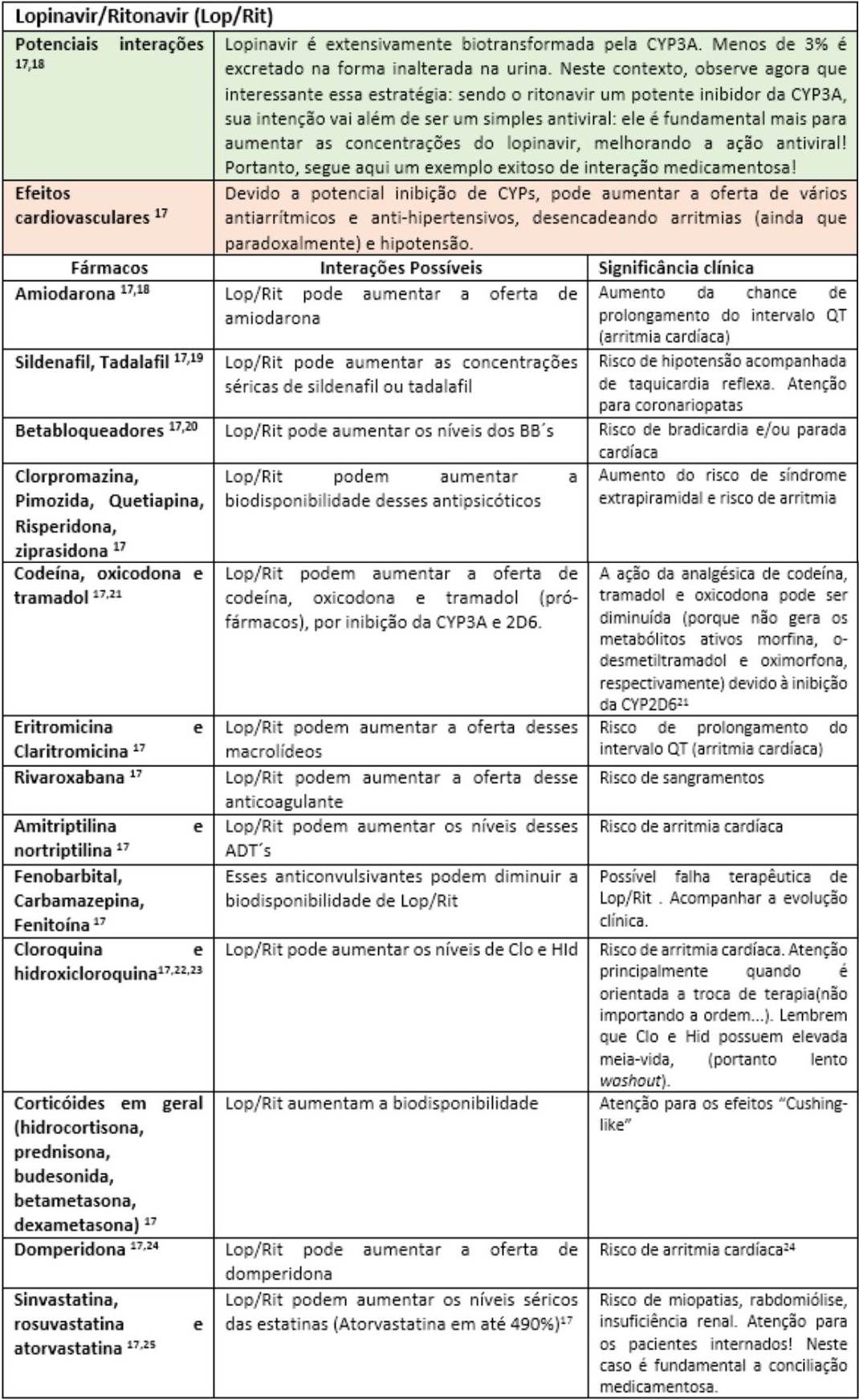
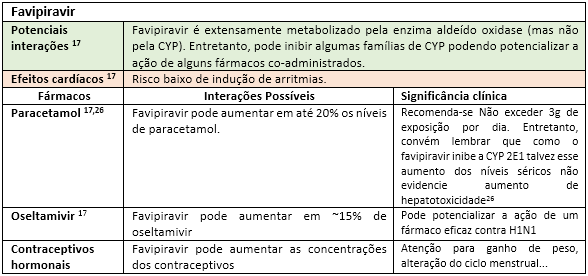
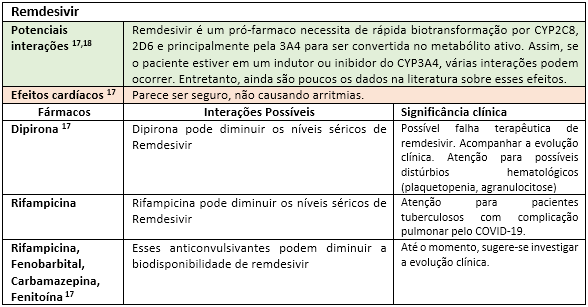
Até o momento, outras substâncias utilizadas nos trials como interferon e o antagonista dos receptores de IL-6 (Tocilizumab) parecem não apresentar interações medicamentosas relevantes17. Todavia, convém enfatizar que o impacto da interação pode estar vinculado ao tempo de exposição, justificando assim o dinamismo das informações sobre interações ao longo da história. Fica aqui então implícita a informação de que esta lista de forma alguma se encerra aqui, merecendo atualizações constantes. Portanto, farmacêutico, esteja atento às novas publicações científicas, pois sua participação na equipe multiprofissional de saúde é fundamental para identificar, registrar e auxiliar nas intervenções de forma responsável visando o bem comum: o sucesso do restabelecimento dos nossos pacientes.
Referências:
1) Doshi P. The elusive definition of pandemic influenza. Bull World Health Organ. 2011 Jul 1;89(7):532-8. doi: 10.2471/BLT.11.086173. PubMed PMID: 21734768; PubMed Central PMCID: PMC3127275.
2) Juarez M, Schcolnik-Cabrera A, Dueñas-Gonzalez A. The multitargeted drug ivermectin: from an antiparasitic agent to a repositioned cancer drug. Am J Cancer Res. 2018;8(2):317–331. Published 2018 Feb 1.
3) GautretP, Lagier JC, Parola P, et al. Hydroxychloroquine and azithromycin as a treatment of COVID-19: results of an open-label non-randomized clinical trial [published online ahead of print, 2020 Mar 20]. Int J Antimicrob Agents. 2020;105949. doi:10.1016/j.ijantimicag.2020.105949
4) Chico RM, Chandramohan D. Azithromycin plus chloroquine: combination therapy for protection against malaria and sexually transmitted infections in pregnancy. Expert Opin Drug Metab Toxicol. 2011;7(9):1153–1167. doi:10.1517/17425255.2011.598506
5) Chatre C, Roubille F, Vernhet H, Jorgensen C, Pers YM. Cardiac Complications Attributed to Chloroquine and Hydroxychloroquine: A Systematic Review of the Literature. Drug Saf. 2018;41(10):919–931. doi:10.1007/s40264-018-0689-4
6) Makanjuola RO, Dixon PA, Oforah E. Effects of antimalarial agents on plasma levels of chlorpromazine and its metabolites in schizophrenic patients. Trop Geogr Med. 1988;40(1):31–33.
7) Finielz P, Gendoo Z, Chuet C, Guiserix J. Interaction between cyclosporin and chloroquine. Nephron. 1993;65(2):333. doi:10.1159/000187506
8) Sindrup SH, Arendt-Nielsen L, Brøsen K, et al. The effect of quinidine on the analgesic effect of codeine. Eur J Clin Pharmacol. 1992;42(6):587–591. doi:10.1007/bf00265920
9) Seideman P, Albertioni F, Beck O, Eksborg S, Peterson C. Chloroquine reduces the bioavailability of methotrexate in patients with rheumatoid arthritis. A possible mechanism of reduced hepatotoxicity. Arthritis Rheum. 1994;37(6):830–833. doi:10.1002/art.1780370609
10) Masimirembwa CM, Naik YS, Hasler JA. The effect of chloroquine on the pharmacokinetics and metabolism of praziquantel in rats and in humans. Biopharm Drug Dispos. 1994;15(1):33–43. doi:10.1002/bdd.2510150103
11) Mayo Clinic. Acesso em 06/04/2020. Fonte: https://www.mayoclinic.org/drugs-supplements/fluoxetine-oral-route/precautions/drg-20063952?p=1
12) Anesthesia Patient Safety Foundation: https://www.apsf.org/ddi/summary-of-chloroquine-and-hydroxychloroquine-drug-drug-interactions/
13) Schwarz ER, Czer LS, Simsir SA, Kass RM, Trento A. Amiodarone-induced QT prolongation in a newly transplanted heart associated with recurrent ventricular fibrillation. Cardiovasc J Afr. 2010;21(2):109–112.
14) Somer M, Kallio J, Pesonen U, Pyykko K, Huupponen R, Scheinin M. Influence of hydroxychloroquine on the bioavailability of oral metoprolol. British Journal of Clinical Pharmacology. 2000 May;49(6)549-554.
15) Liverpool Drug Interactions Group. Último update: 3 de abril de 2020. https://www.covid19-druginteractions.org/
16) Hughes PJ, Cretton-Scott E, Teague A, Wensel TM. Protease Inhibitors for Patients With HIV-1 Infection: A Comparative Overview. P T. 2011;36(6):332–345.
17) Chinello P, Cicalini S, Pichini S, Pacifici R, Tempestilli M, Petrosillo N. Sildenafil plasma concentrations in two HIV patients with pulmonary hypertension treated with ritonavir-boosted protease inhibitors. Curr HIV Res. 2012;10(2):162–164. doi:10.2174/157016212799937263
18) Foy M, Sperati CJ, Lucas GM, Estrella MM. Drug interactions and antiretroviral drug monitoring. Curr HIV/AIDS Rep. 2014;11(3):212–222. doi:10.1007/s11904-014-0212-1
19) Hsu A, Granneman GR, Bertz RJ. Ritonavir. Clinical pharmacokinetics and interactions with other anti-HIV agents [published correction appears in Clin Pharmacokinet 1998 Dec;35(6):473]. Clin Pharmacokinet. 1998;35(4):275–291. doi:10.2165/00003088-199835040-00002
20) Fehintola FA, Akinyinka OO, Adewole IF, Maponga CC, Ma Q, Morse GD. Drug interactions in the treatment and chemoprophylaxis of malaria in HIV infected individuals in sub Saharan Africa. Curr Drug Metab. 2011;12(1):51–56. doi:10.2174/138920011794520008
21) van Waterschoot RA, ter Heine R, Wagenaar E, et al. Effects of cytochrome P450 3A (CYP3A) and the drug transporters P-glycoprotein (MDR1/ABCB1) and MRP2 (ABCC2) on the pharmacokinetics of lopinavir. Br J Pharmacol. 2010;160(5):1224–1233. doi:10.1111/j.1476-5381.2010.00759.x
22) Charbit B, Rosier A, Bollens D, et al. Relationship between HIV protease inhibitors and QTc interval duration in HIV-infected patients: a cross-sectional study. Br J Clin Pharmacol. 2009;67(1):76–82. doi:10.1111/j.1365-2125.2008.03332.x
23) Piliero PJ. Interaction between ritonavir and statins. Am J Med. 2002;112(6):510–511. doi:10.1016/s0002-9343(02)01034-3.
24) Zhao Y, Harmatz JS, Epstein CR, et al. Favipiravir inhibits acetaminophen sulfate formation but minimally affects systemic pharmacokinetics of acetaminophen. Br J Clin Pharmacol. 2015;80(5):1076–1085. doi:10.1111/bcp.12644
Participe também: Grupo de WhatsApp para receber notícias farmacêuticas diariamente









