Muito além de um relatório exigido pela legislação sanitária, a Revisão da Qualidade do Produto (RQP) representa uma oportunidade estratégica de aprimoramento contínuo na indústria farmacêutica. A prática, prevista no Anexo I da Resolução da Diretoria Colegiada (RDC) 658/2022, da Agência Nacional de Vigilância Sanitária (Anvisa), é essencial para garantir a consistência dos processos e a conformidade dos medicamentos ao longo do seu ciclo de vida.
“A RQP permite que a empresa farmacêutica avalie se seus processos continuam sob controle e se o produto segue atendendo às especificações com segurança, eficácia e qualidade”, afirma a professora do ICTQ – Instituto de Pesquisa e Pós-Graduação para o Mercado Farmacêutico, Patrícia Moreira da Silveira. Segundo ela, embora algumas organizações ainda vejam a RQP como um simples cumprimento regulatório, seu verdadeiro valor está na gestão integrada da qualidade.
O que é a RQP?
De acordo com a RDC 658/2022, a RQP é uma atividade anual, conduzida com base nos princípios do Gerenciamento de Riscos da Qualidade (GRQ) e da melhoria contínua. Seu objetivo é verificar se o produto segue sendo fabricado dentro dos parâmetros esperados, considerando não apenas os dados do produto acabado, mas também informações sobre processos, desvios, reclamações, estabilidade, mudanças implementadas e eficácia das ações corretivas e preventivas (CAPAs).
A revisão deve contemplar todos os medicamentos fabricados ou importados pela empresa, incluindo aqueles em contrato com terceiros, e envolver departamentos diversos: garantia da qualidade, produção, controle de qualidade, assuntos regulatórios e farmacovigilância.
Para Patrícia, essa abordagem multidisciplinar é fundamental. “A RQP fortalece a comunicação entre áreas e ajuda a consolidar uma cultura de qualidade em toda a organização”, explica.
Benefícios da RQP bem estruturada
Quando conduzida corretamente, a RQP oferece ganhos que extrapolam a conformidade com a norma. A professora do ICTQ destaca pelo menos seis benefícios diretos da sua implementação eficaz:
- Consolidação do histórico do produto: facilita o acesso rápido a dados críticos sobre sua performance, permitindo rastreabilidade e decisões embasadas.
- Análise de tendências e variabilidade: por meio do controle estatístico de processos (CEP), é possível detectar desvios antes que impactem a qualidade do produto.
- Gestão de mudanças mais assertiva: ao compreender o comportamento histórico dos processos, a empresa pode propor melhorias com menor risco.
- Evidências de robustez de processo: as análises feitas na RQP servem como base para validações e revalidações de processos e métodos analíticos.
- Melhoria contínua da qualidade: a prática favorece a identificação de pontos críticos e oportunidades de melhoria sistemática.
- Atendimento a inspeções sanitárias e auditorias: a documentação clara e consolidada da RQP demonstra o comprometimento da empresa com as Boas Práticas de Fabricação (BPF).
Estratégia e qualidade de dados
A professora reforça que uma RQP eficiente começa com planejamento e estratégia. “É fundamental definir os parâmetros que realmente impactam o produto e garantir que os dados sejam coletados de forma padronizada e com qualidade”, alerta.
O uso de sistemas informatizados, como Laboratory Information Management System (LIMS), Manufacturing Execution System (MES) e ferramentas de business intelligence (BI), contribui para a centralização e integridade dos dados, além de facilitar a análise estatística.
A RQP, quando bem conduzida, dialoga com diversas ferramentas e sistemas já adotados na indústria farmacêutica. Um exemplo é o Quality by Design (QbD), que fornece a base conceitual sobre os atributos críticos do produto (CQAs) e os parâmetros críticos de processo (CPPs).
Outro ponto de conexão é o Sistema de Gestão da Qualidade descrito na diretriz internacional ICH Q10, que recomenda a revisão periódica do desempenho do produto e do processo como parte da melhoria contínua.
“A RQP não pode ser feita de forma isolada. Ela deve estar conectada a todo o sistema de qualidade farmacêutica da empresa, com apoio da alta gestão e com foco em inovação e sustentabilidade”, afirma Patrícia.
Estatística aplicada à tomada de decisão
A tabulação do grande volume de dados pode mascarar informações sobre o processo. Com isso, a integração das ferramentas estatísticas e o CEP transformam a RQP em uma ferramenta de gestão da qualidade. No lugar de uma análise retrospectiva, ela se torna proativa, dando suporte à tomada de decisão.
As principais contribuições são:
- Quantificação da variabilidade: dados como média, desvio padrão, amplitude e análise de variância permitem mensurar a dispersão dos dados e entender o comportamento do processo.
- Identificação de tendências e padrões: o uso de gráficos de controle para monitorar parâmetros críticos de processo (CPPs) e atributos críticos de qualidade (CQAs) permite distinguir entre variabilidade comum e variabilidade por causas especiais.
- Avaliação da capacidade do processo: índices de capacidade, como Cp e Cpk, permitem avaliar se o processo é capaz de produzir produtos dentro das especificações, de forma consistente.
- Tomada de decisão: no lugar de intuição ou observações de dados isolados, as decisões sobre a necessidade de ações, como CAPAs, revalidação, ajustes no processo ou nas especificações, são baseadas em dados estatísticos.
Exemplos práticos
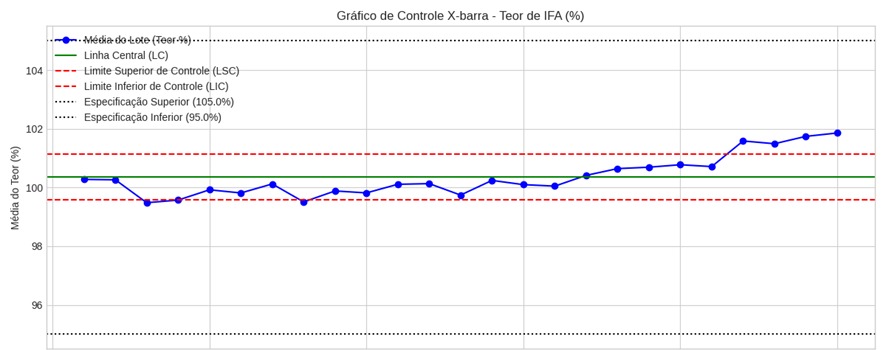
a) Tendência de teor em comprimido (gráfico X-barra)
Ao avaliar o gráfico X-barra de um comprimido, observou-se uma tendência crescente de teor nos últimos meses, ainda dentro da especificação. A análise estatística direcionou a necessidade de uma investigação para identificar e corrigir a causa raiz, antes da ocorrência de uma não conformidade. As possíveis causas para essa tendência incluíam o desgaste de um componente da compressora, variação na matéria-prima, ou outros fatores.
b) Reclamações de embalagem (gráfico de Pareto e tendência)
Avaliando os gráficos de Pareto e de análise de tendência de reclamações de mercado, observou-se que os dados estratificados indicaram que 80% das queixas de determinado produto se referiam a “embalagem danificada”, com tendência de aumento nos últimos seis meses. Essas informações direcionaram a investigação para o processo de embalagem secundária ou para a qualidade do material de embalagem utilizado no período.